Bt-Toxine (von Bacillus thuringiensis δ-Endotoxine) sind Giftstoffe, die von der Bakterienart Bacillus thuringiensis produziert werden können. Sie zählen zu den Proteinen und werden in Abhängigkeit von ihrem Wirkmechanismus eingeteilt in die drei Gruppen der Cry-Toxine (englisch crystal toxins, zusammengefasst auch als parasporin bezeichnet), der Cyt-Toxine (englisch cytolytic toxins) und der VIP-Toxine.
Eigenschaften
Viele Bacillus thuringiensis-Stämme (Bt) produzieren diese Endotoxine als Präproteine, die sich in kristallinen Einschlüssen während der Sporulation der Bakterien anlagern. Im Darm des Wirtsorganismus werden diese Kristalle aufgelöst und die Präproteine geschnitten. Dabei entstehen funktionsfähige Proteine, die nur in den Stoffwechsel des Zielorganismus eingreifen und somit als Insektizid wirken. Die Wirksamkeit und Spezifität des Bt-Cry-Toxins haben es zu einem weit verwendeten Mittel in der Landwirtschaft werden lassen. Es gilt für Nicht-Insekten, wie den Menschen, als ungiftig und ist daher zum Beispiel auch im ökologischen Landbau ein zertifiziertes Mittel. Auch wurden mithilfe der Gentechnik sogenannte Bt-Pflanzen hergestellt, die Bt-Toxine synthetisieren. Bt-Toxine werden seit 1938 als Insektizide eingesetzt.
Cry-Toxine
Cry-Toxine werden als Prototoxine gebildet und entfalten unter bestimmten Einflüssen im Insektenkörper ihre Wirkung. Das Präprotein des Toxins kann sich nur im alkalischen Milieu, wie im Verdauungstrakt der Insekten, lösen. Artspezifische Proteasen schneiden dann das aktive toxische Zentrum frei, welches bis dahin am N-Terminus des Prototoxins hing. Das Toxin erkennt bestimmte Kohlenwasserstoffstrukturen an der Oberfläche von Zellen im Verdauungstrakt der Insektenlarven und verursacht dort als porenbildendes Toxin die Bildung von Poren, die das osmotische Potential der Zelle zerstören und damit Cytolyse bewirken.
Aufbau
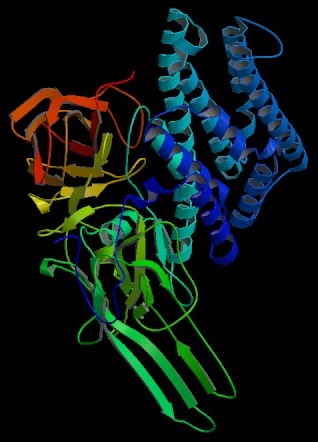
Cry-Toxine bestehen aus drei Domänen. Eine Domäne besteht großteils aus α-Helices, die anderen beiden aus β-Faltblattstrukturen. Homologien zwischen den einzelnen Cry-Toxinen finden sich nur in fünf strukturerhaltenden Bereichen im Inneren des Proteins, während alle anderen unterschiedlich auf die spezifischen Wirtsbedingungen zugeschnitten sind.
Die α-Helices-Domäne (I) besteht aus sieben Helices, die für die Entstehung der Membranporen zuständig sind. Während die zentrale Helix hydrophob, also wasserabweisend ist, verhalten sich alle anderen amphipathisch: Die äußeren Bereiche sind hydrophil und die inneren hydrophob. Fünf der externen Helices sind lang genug um eine 30 ‰ Membran zu durchspannen. Dabei kommt es zu einer Inversion der hydrophob/hydrophilen Bereiche, so dass die Lipide der Membran an die hydrophoben Bereiche der Helices angrenzen.
Die zweite Domäne ist für die Bindung am Zell-Rezeptor verantwortlich. Sie besteht aus drei antiparallelen β-Flächen, die eine sogenannte β-Prisma-Struktur bilden. Jede der Flächen bildet eine Schleife auf einer Seite des Prismas aus, die als funktionelles Lektin Glykosylierungen an der Membranoberfläche erkennen und binden kann.
Die dritte Domäne besteht aus zwei ineinander verschlungenen β-Faltblatt-Strukturen, die eine sogenannte Jelly-roll-Oberfläche bilden. Ihre Funktion ist noch nicht vollständig erforscht, jedoch ist sicher, dass sie einen stabilisierenden Effekt auf das Protein hat. Die Domäne schließt ein Loch zwischen den anderen beiden Domänen und schützt das Toxin so vor Proteasen. Zum anderen enthält diese Domäne mindestens zwei Bindungsstellen, die – so wird angenommen – nicht nur wie Lektin spezifische Kohlenwasserstoffe, sondern auch Peptide binden können.
Verwendung in Saatgut
Die erste Generation von Bt-Maissorten kam 1997 auf den Markt. Dazu gehörten MON 810 mit dem cry1Ab-Gen für Toxizität gegen Maiszünsler (Ostrinia nubilalis, Kurzbezeichnung ECB für European Corn Borer) und MON 863 mit Resistenz gegen den Westlichen Maiswurzelbohrer (Diabrotica virgifera, Kurzbezeichnung CRW für corn rootworm). Den Durchbruch für den kommerziellen Erfolg dieser Pflanzen brachten die Stacked Traits, also gestapelte Eigenschaften mit mehr als einen Resistenzgen. Dazu gehören MON 89034, welcher die Glyphosat-Toleranz mit den Proteinen Cry1A.105 und Cry2Ab2 (gegen ECB) kombiniert, und MON 88017, welcher die Glyphosat-Toleranz mit der CRW-Resistenz von MON 863 kombiniert. Der letzte Schritt in dieser Entwicklung war SmartStax (MON 89034 × TC1507 × MON 88017 × DAS-59122-7), welches zwei Toxine gegen CRW (Cry34Ab1/Cry35Ab1 und Cry3Bb1), drei gegen ECB und weitere Schädlinge (Cry 1A.105, Cry2Ab2, Cry1F) sowie Glyphosat- und Glufosinat-Toleranz enthält.
Resistenzen von Schadinsekten
In der Vergangenheit wurden verschiedene Schadinsekten gefunden, die gegenüber einzelnen Bt-Toxinen resistent sind. Im Sommer 2009 wurde in Iowa die Resistenz des Westlichen Maiswurzelbohrers gegen Cry3Bb1 entdeckt. Der wahrscheinliche Grund ist dabei meist eine nicht-rezessive Vererbung sowie eine unzureichende Einhaltung von Refugienflächen (Flächen, auf denen nicht-transgene Pflanzen angepflanzt werden). Um möglichen Resistenzbildungen bei Zielinsekten entgegenzuwirken, wurden 2007 an der Universität von Mexiko (UNAM) erstmals ein Gen und das dadurch erzeugte Bt-Toxin so verändert, dass es wieder wirksam wurde. Auf diesen Forschungen aufbauend und mit Hilfe von Erkenntnissen zum Mechanismus von Resistenzbildung bei Fraßschädlingen präsentierte 2011 eine internationale Forschergruppe die modifizierten Proteine Cry1AbMod und Cry1AcMod. Die neuen Toxine erwiesen sich als sehr effizient gegen Schädlinge, die ihre Resistenz auf Grund verschiedener Mutationen erlangt hatten. Weitere Forschungen haben die Eignung für die Landwirtschaft zum Ziel, um eine sichere Wirkung gegen Fraßschädlinge zu garantieren.
Liste von δ-Endotoxinen
Weblinks
- Bacillus thuringiensis Toxin Nomenclature
Einzelnachweise


![]()