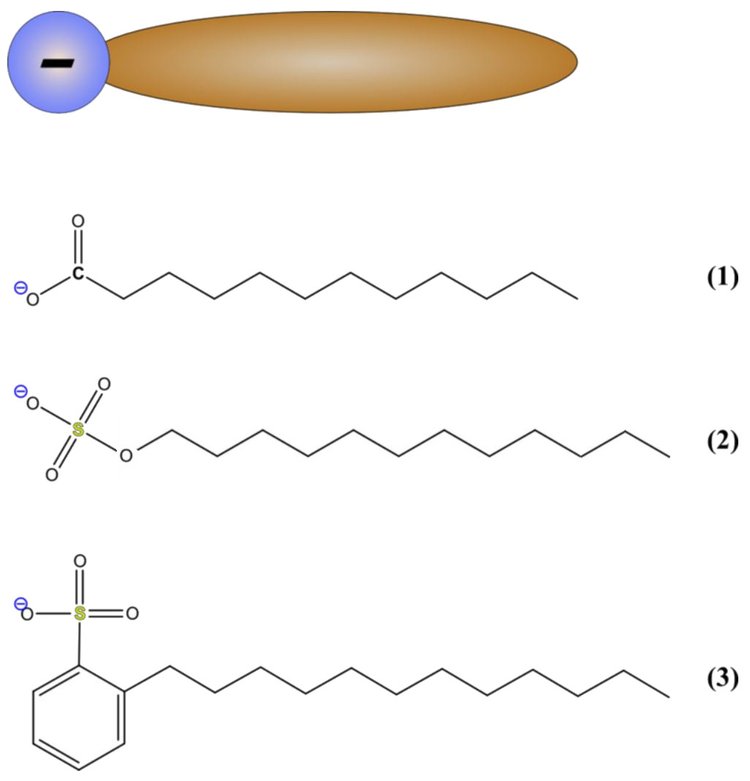
Als anionische Tenside bezeichnet man Tenside, die eine negativ geladene funktionelle Gruppe besitzen. Wie alle Tenside sind auch die anionischen Tenside aus einem polaren und einem unpolaren Teil aufgebaut. Als unpolarer Teil dient ein Alkylrest. Die polare funktionelle Gruppe ist –COO−(Carboxylat), –SO3−(Sulfonat) oder –SO42−(Sulfat).
Typische Vertreter
- Alkylcarboxylate (= Seife): R–COO−Na , mit R = gesättigter oder ungesättigter, linearer Alkylrest, je nach Fettsäuretyp
- Alkylbenzolsulfonate (ABS): CnH2n 1–C6H4–SO3−Na , zum Beispiel: Natriumdodecylbenzolsulfonat
- sekundäre Alkylsulfonate (auch Alkansulfonate, SAS): CnH2n 1-SO3−Na , auch fluoriert, zum Beispiel Kalium-N-ethyl-N-[(heptadecafluoroctyl)sulfonyl]glycinat
- Fettalkoholsulfate (FAS): H3C–(CH2)n–CH2–O–SO3−Na [n = 8–16], zum Beispiel: Natriumlaurylsulfat
- Alkylethersulfate, z. B. Natriumdodecylpoly(oxyethylen)sulfat (SLES)
- Sulfoacetate
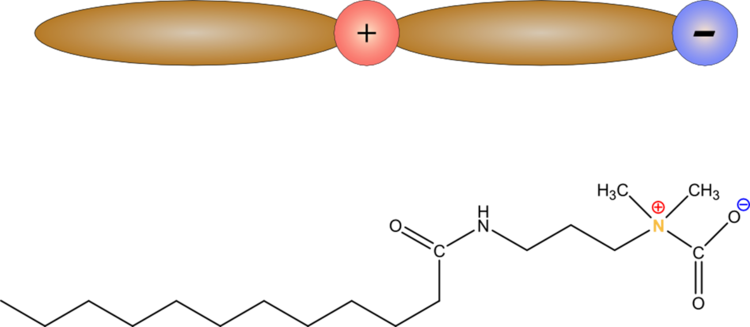
- Tauride mit der allgemeinen Struktur:
Verwendung
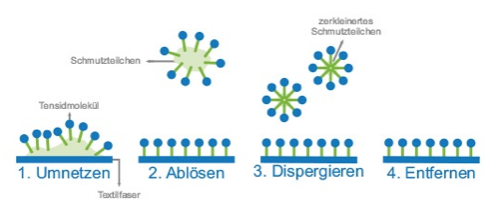
Die Sulfonate ABS und SAS zeigen gute Benetzungseigenschaften und können auch in hartem Wasser eingesetzt werden; sie werden vor allem in pulverförmigen Textilwaschmitteln eingesetzt. Seifen hingegen sind nur beschränkt einsetzbar, da sie in hartem Wasser unlösliche Kalkseifen bilden und daher unwirksam werden.
Herstellung
Alkylbenzolsulfonate
Das aus der Friedel-Crafts-Alkylierung gewonnene Alkylbenzol wird mit rauchender Schwefelsäure sulfoniert und mit Lauge neutralisiert. Reaktionen:
1. Addition:
Die Addition wird durch H -Ionen katalysiert.
2. elektrophile Substitution:
3. Neutralisation:
Seifen
Die Seifen gewinnt man direkt durch basische Hydrolyse von Fetten und fetten Ölen, d. h., die Fette werden mit Basen wie Kalilauge oder Natronlauge zu Seifen umgesetzt (Verseifung). Mit Natronlauge werden Kernseifen, mit Kalilauge Schmierseifen hergestellt:
Früher wurden Seifen aus Tierfetten mit Hilfe von Soda (Na2CO3) oder Pottasche (K2CO3) gewonnen:
Mit den unterschiedlichen Kationen können die oben beschriebenen Seifen hergestellt werden.
Fettalkoholsulfate
Fettalkoholsulfate werden durch Umsetzung eines Fettalkohols mit Schwefeltrioxid gewonnen. Reaktion:
Ökologie
Einige Tenside werden durch Kleinstlebewesen der Gewässer schlecht abgebaut. Schaumberge bedeckten daher weite Flächen der Gewässer, bis 1961 das Detergentiengesetz nur noch Tenside zuließ, die zu wenigstens 80 % biologisch abbaubar sind.
Einzelnachweise